背景
酒さにおける紅斑と潮紅の治療は困難である。カルシトニン遺伝子関連ペプチド(CGRP)は酒さの病態と関連しており、CGRP経路の阻害がこの疾患のある特徴を改善する可能性がある。酒さに伴う紅斑と潮紅の治療に対する抗CGRP受容体モノクローナル抗体であるエレヌマブの有効性,忍容性,安全性を検討する。ClinicalTrials.gov NCT04419259。
方法
この単施設、非盲検、単群、非ランダム化比較試験は、2020年6月9日から2021年5月11日の間に実施された。対象は、中等度から重度の紅斑および/または中等度から極度の潮紅のいずれかが15日以上認められる酒さの成人患者であった。試験期間中、酒さ治療の併用は禁止された。訪問はデンマーク、コペンハーゲンのRigshospitaletにあるコペンハーゲン大学病院のデンマーク頭痛センターで行われた。参加者はエレヌマブ140mgを4週間ごとに12週間皮下投与された。安全性追跡調査は20週目に行われた。データ解析は2023年1月から2024年1月にかけて行われた。エレヌマブ140mgを4週ごとに12週間投与。主要アウトカムは、4週間のランイン期間(ベースライン)と比較した、9~12週目の中等度から極度の潮紅を認めた日数の平均変化とした。中等度から重度の紅斑を認めた日数の平均変化は副次評価項目とした。有害事象は、エレヌマブを少なくとも1回投与された参加者について記録された。平均値の差はペアのt検定で算出した。
結果
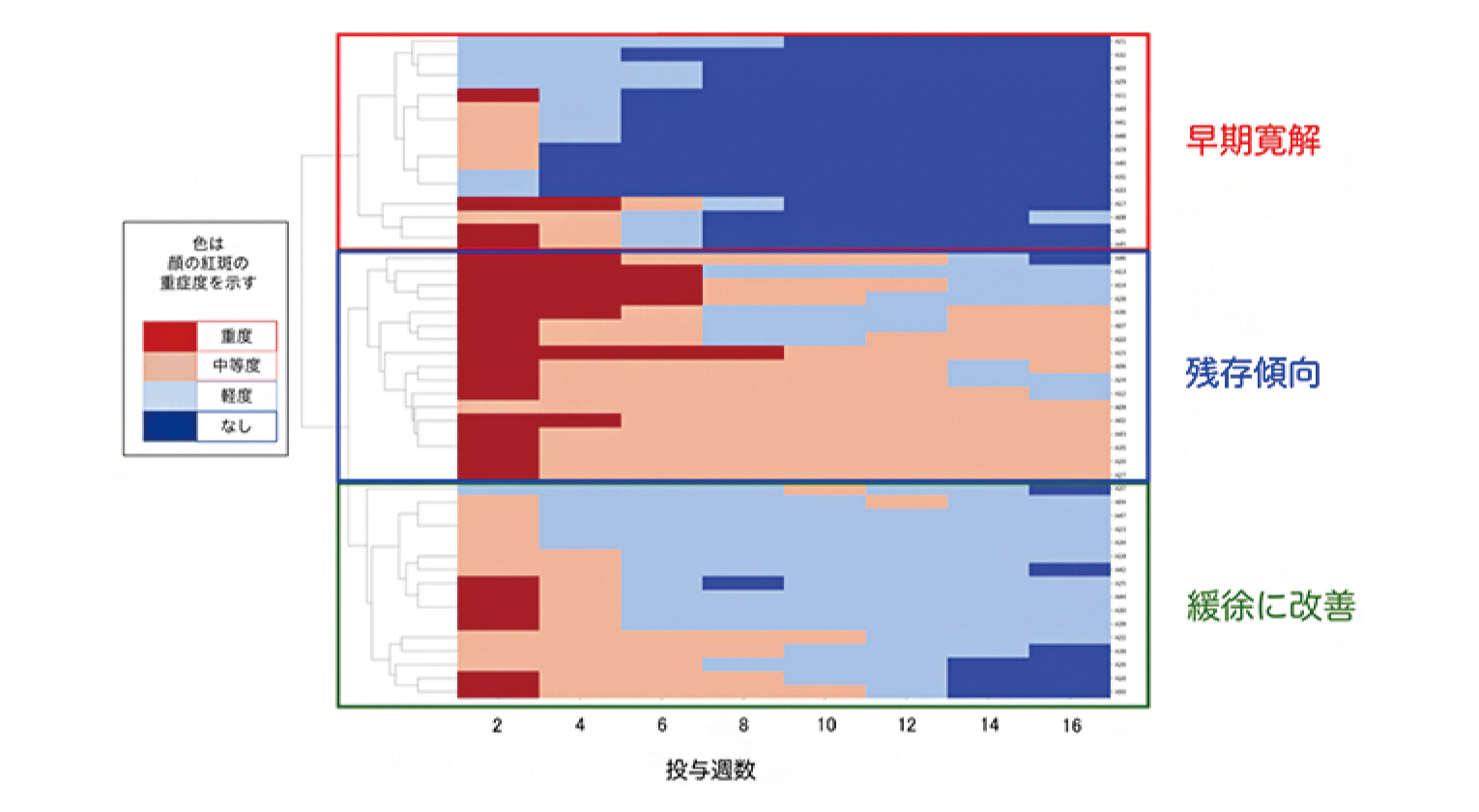
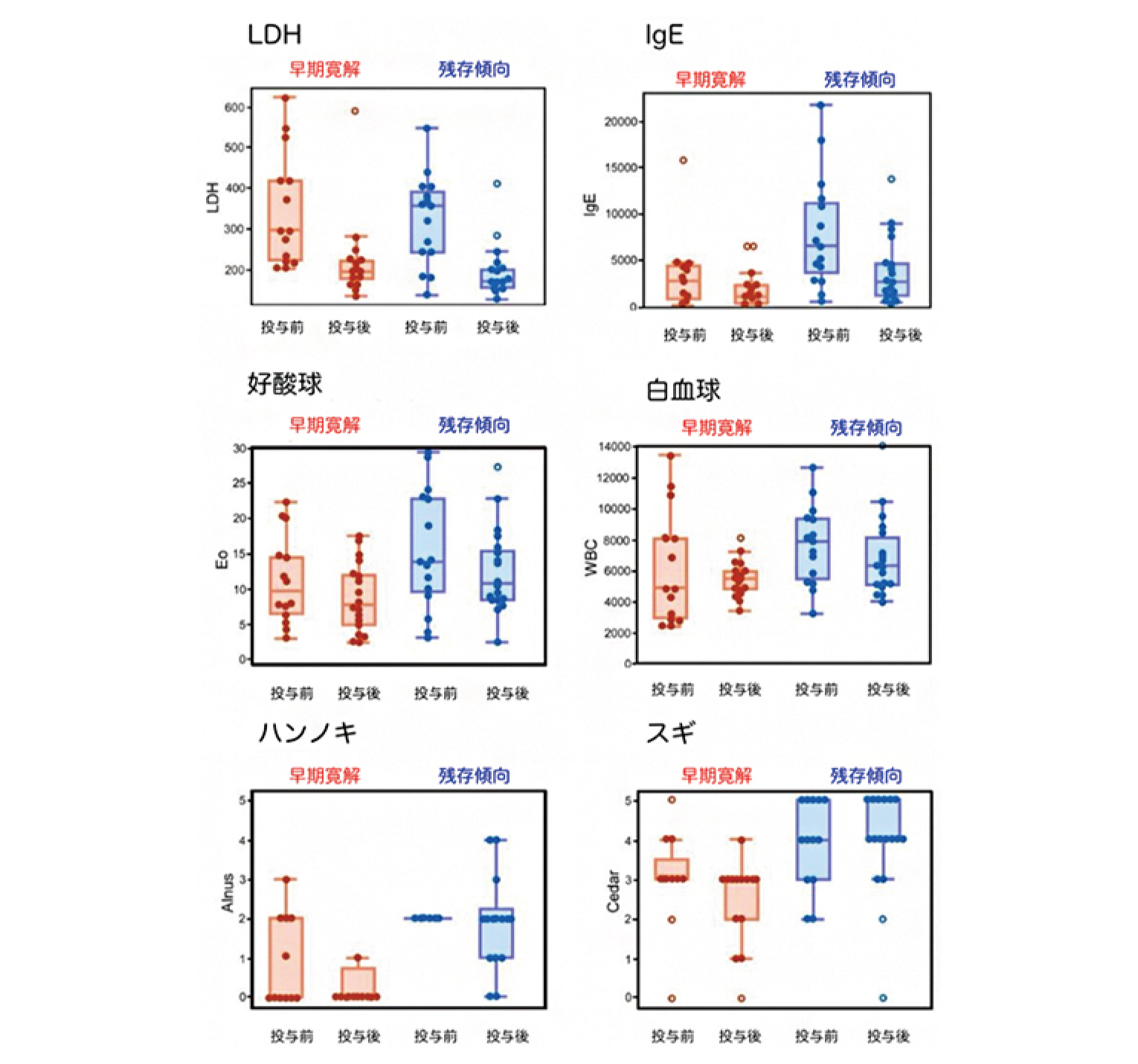
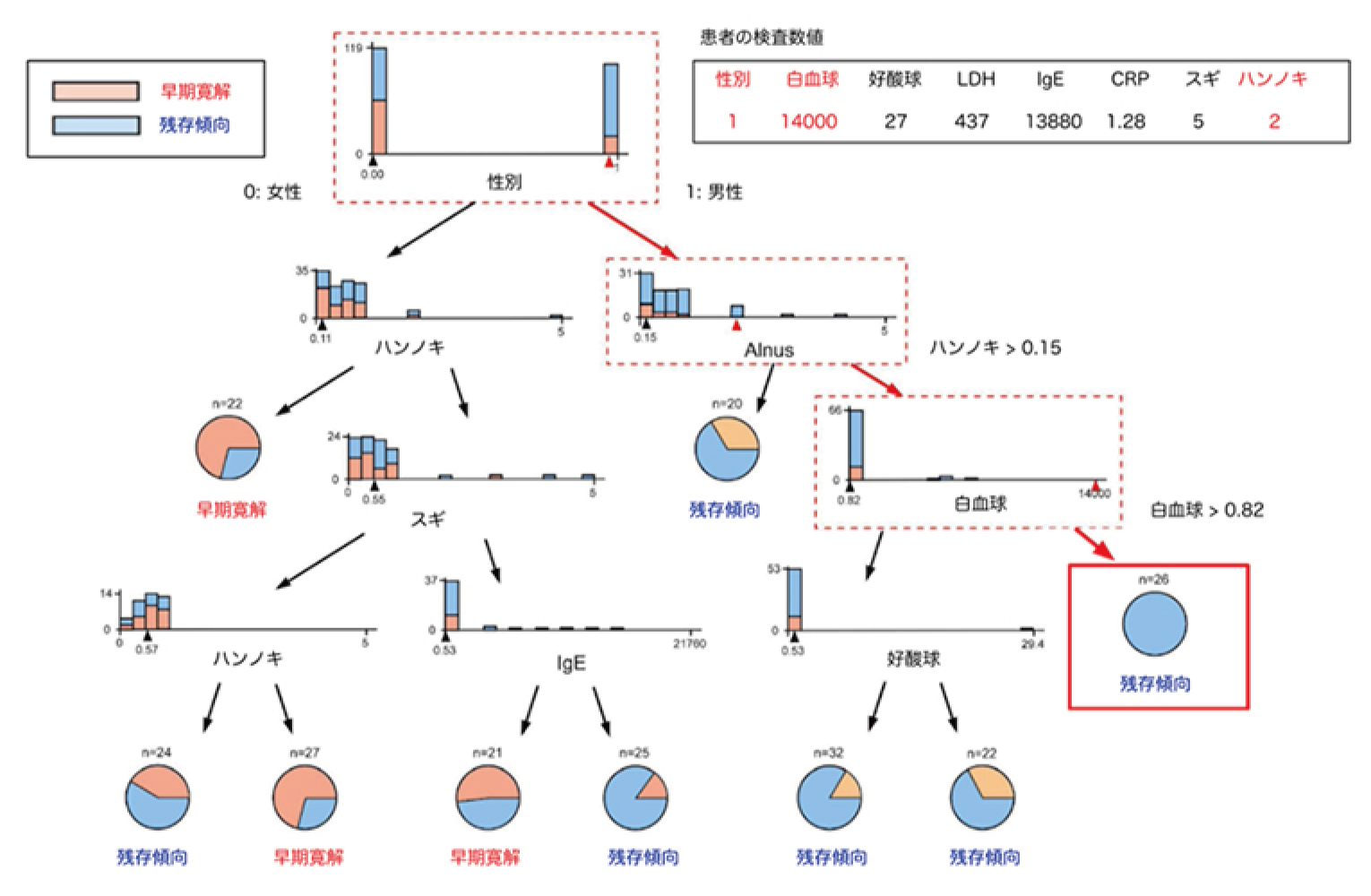
合計30人の参加者(平均[SD]年齢、38.8[13.1]歳;女性23人[77%];男性7人[23%])が組み入れられ、このうち27人が12週間の試験を完了した。中等度から極度の潮紅の平均(SD)日数は、ベースライン時の23.6(5.8)日から-6.9日(95%CI、-10.4~-3.4日;P < 0.001)減少した。中等度から重度の紅斑の平均(SD)日数は、ベースライン時の15.2(9.1)日から-8.1日(95%CI、-12.5~-3.7日;P < 0.001)減少した。有害事象は、一過性の軽度~中等度の便秘(10人[33%])、一過性の顔面紅潮の悪化(4人[13%])、腹部膨満感(3人[10%])、上気道感染(3人[10%])などであり、過去のデータと一致していた。1人の参加者は重篤な有害事象(試験とは無関係と判断された胆石による入院)により試験を中止し、2人の参加者は時間がないため同意を取り下げた。これらの所見から、エレヌマブは酒さに関連した潮紅と慢性紅斑の軽減に有効である可能性が示唆され(参加者は一般的に治療に対する忍容性が高く、これは以前のデータと一致していた)、CGRP受容体阻害は酒さに関連した紅斑と潮紅の治療に可能性がある。この所見を確認するためには、より大規模なランダム化臨床試験が必要である。